免疫应答(immune response)是机体免疫系统受到抗原刺激后,抗原特异性淋巴细胞识别抗原,发生活化、增殖和分化,发挥体液免疫和细胞免疫的效应过程。特异性免疫应答是机体清除异己物质以保持内环境稳定的重要机制,这个过程是免疫系统各部分生理功能的综合体现,包括抗原提呈、淋巴细胞活化及免疫效应发生等一系列复杂而有序的反应。抗原提呈是免疫应答过程的核心环节,是机体免疫反应的始动者。在免疫应答过程中,能摄取、加工、处理抗原并将抗原信息提呈给淋巴细胞的细胞,称为抗原提呈细胞antigen presenting cell,APC),包括树突细胞(dendritic cell,DC)、巨噬细胞、B细胞等,在免疫应答中具有独特的地位。目前免疫学的研究对于经典的抗原提呈途径了解得比较清楚,即外源性抗原通过主要组织相容性复合体(major histocompatibility complex,MHC)Ⅱ类分子的途径被提呈,内源性抗原通过MHC-Ⅰ类分子的途径被提呈。外源性抗原(抗原提呈细胞外的抗原,如被吞噬的细胞或细菌等)被抗原提呈细胞捕获后经吞噬、吞饮或受体介导的内吞作用进入胞内,在溶酶体或内体内被降解为抗原肽片段,与M+HC-Ⅱ类分子形成抗原肽-MHC-Ⅱ类分子复合物,转运至细胞膜,提呈给CD4T细胞,也称为溶酶体提呈途径。内源性抗原(指细胞内合成的抗原,如被病毒感染细胞合成的病毒蛋白和肿瘤细胞内合成的蛋白等)被蛋白酶体降解为肽片段,由TAP分子(transporters associated with antigen processing)转运至内质网内,与MHC-Ⅰ类分子结合形+成抗原肽-MHC-Ⅰ类分子复合物,然后经高尔基体被运至细胞表面,提呈给CD8T细胞,也称为胞质溶胶途径。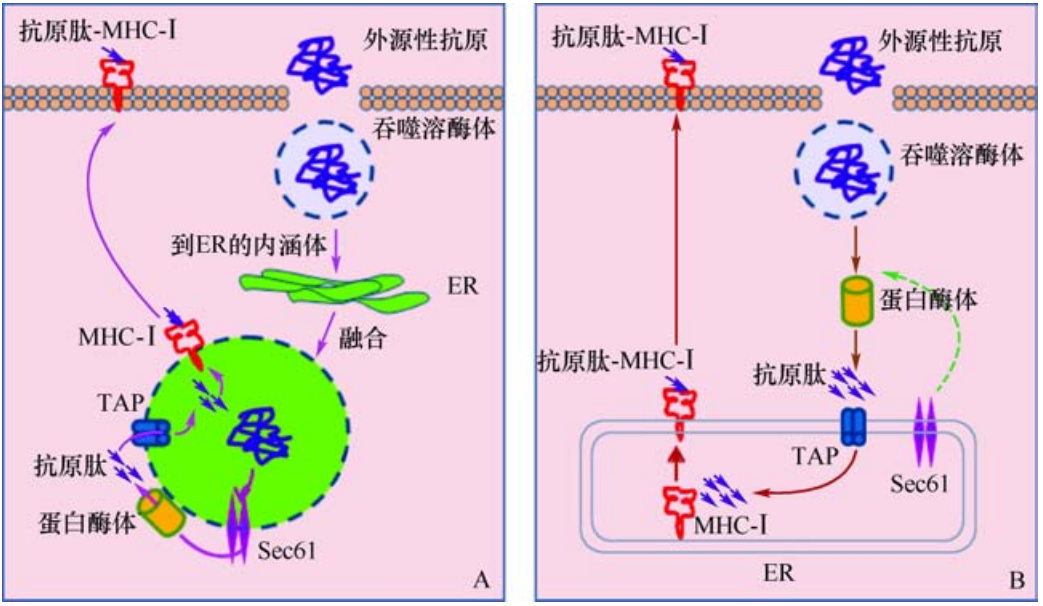
除了经典的抗原提呈途径,近年来发现一个违背经典途径的有趣现象,即机体内还存在着非经典的提呈途径。外源性抗原也可通过MHC-Ⅰ类分子途径提呈,活化CD8+T细胞,这一现象称为交叉提呈(cross-presentation)。专职性APC如树突细胞是具有交叉提呈功能的主要细胞,树突细胞通过其表面MHC-Ⅰ类分子对外源性抗原的交叉提呈可诱导CD8+细胞毒性T细胞。交叉提呈机制在机体抗病毒及胞内菌感染、肿瘤免疫及自身耐受中具有至关重要的作用,越来越受到关注并成为研究的热点,关于交叉提呈近年在国际顶级期刊上都有报道。理论上交叉提呈应该有两个层面的意思,即内源性抗原的MHC-Ⅱ类提呈和外源性抗原的MHC-Ⅰ类提呈,不过认为外源性抗原的MHC-Ⅰ类提呈(诱导细胞毒性T细胞)在对抗肿瘤与病毒性疾病中更具重要性,故对该途径提呈的机制研究得较多。已发现了一些参与交叉提呈过程的分子,但其发生的确切机制仍未完全揭开,深入阐明交叉提呈的分子机制对于开发抗肿瘤、抗感染疫苗具有重要意义。
在交叉提呈过程中,关于其发生机制有很多谜团没有解开,关键的问题主要包括:抗原肽到底是如何能够在内体与蛋白酶体之间进行非常规的转移的,是由哪些分子帮助完成的?抗原肽到底是如何与MHC-Ⅰ类分子结合的?交叉提呈受到哪些因素的调控?什么情况下抗原会遵循交叉提呈的途径被提呈,是否跟抗原的性质有关?抗原的特点是怎么样来决定哪一条提呈途径的,还有一些什么样的因素来决定?这对于我们设计疫苗(抗病毒、抗肿瘤等)会有非常好的启发和指导作用,若能使疫苗中的免疫原同时能通过经典的MHC-Ⅱ类分子途径提呈以活化CD4+T细胞,又能通过交叉提呈的途径激活CD8+T细胞,诱导抗原特异性CTL,疫苗将会更加有效。
目前对于交叉提呈机制的研究只是刚刚开始,认识到外源性抗原被MHC-Ⅰ类分子提呈的可能机制包括:APC吞入外源抗原(胞内有病原体感染的细胞、肿瘤细胞等)后,在内体中消化,抗原肽直接与内体中的MHC-Ⅰ类分子结合成复合物而被提呈;内体与细胞表面含MHC-Ⅰ类分子的颗粒融合,外源性抗原肽结合再循环的MHC-Ⅰ类分子而被提呈;含外源性抗原的吞噬溶酶体可与内质网融合,内质网膜上的Sec61(转运分子)使吞噬溶酶体内的小分子抗原肽逆向转运至融合体的胞质面,由胞质内蛋白酶体将其进一步降解,然后在胞质中热休克蛋白(heatshockprotein,HSP)家族成员HSP70的参与下,由内质网表面的TAP将抗原肽转回融合体,并装载至MHC-Ⅰ类分子的抗原结合槽,转运至细胞膜表面被提呈给CD8+T细胞;内体中的外源性抗原或抗原肽还可直接进入胞质,甚至直接从细胞外进入细胞质,再经经典的MHC-Ⅰ类途径处理和提呈,机制尚不十分明确(图1)。热休克蛋白(包括gp96、HSP70、HSP90等)作为胞内含量丰富的可溶性蛋白,在参与抗原(如肿瘤)的交叉提呈中发挥重要作用。肿瘤细胞生长过程中裂解释放的gp96-内源性抗原肽复合物可作为外源性抗原被APC摄取加工处理后,通过交叉提呈作用,以肿瘤抗原肽-MHC-Ⅰ类分子复合物的形式表达于APC表面,供细胞毒性T细胞识别。APC表面CD91分子被证实是与HSP特异性结合的受体。
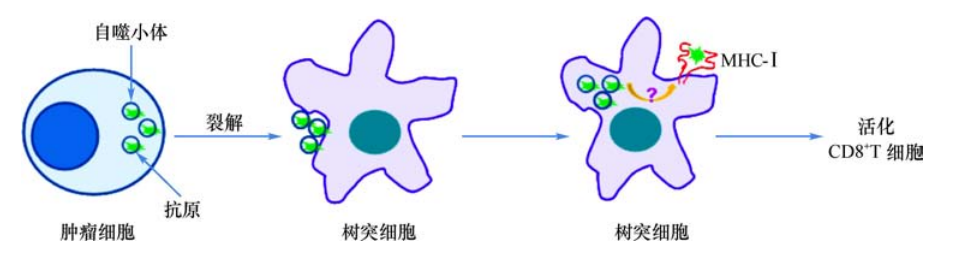
最近的研究还解释了自噬(autophagy)在交叉提呈中的可能作用。自噬是广泛存在于细胞中的一条胞内蛋白降解途径,在自噬过程中,待降解的细胞质组分及细胞器被包裹在一种称为自噬小体(autophagosome)的双层膜结构中,最终与溶酶体形成自噬溶酶体。自噬小体可能是供体细胞转运抗原性蛋白的有效载体,肿瘤细胞自噬小体可作为树突细胞交叉提呈的抗原来源,诱导强烈的抗原特异性CD8+T细胞应答(图2)。胞内病原体(病毒、细菌、寄生虫)的交叉提呈机制中自噬也同样发挥作用,可以看到这些抗原往往定位在自体吞噬泡,阻断自噬就抑制了特异性CD8+T细胞应答。自噬还可以将内源性抗原以MHC-Ⅱ类分子的形式提呈给CD4+T细胞,实现内源性抗原的交叉提呈。
还有研究认为,在对一些病毒抗原的交叉提呈中,可能抗原并不在胞浆中被降解和处理,而是完整的蛋白质被抗原提呈细胞提呈到细胞表面再被降解。
目前已有的研究只对交叉提呈的机制有了一点点认识,在很多问题上还存在着争议,要揭开交叉提呈这一谜团还有非常多的关键问题需要解决,其确切的细胞与分子机制还亟待深入了解,这可能为设计抗肿瘤、抗感染的新策略提供关键的启发。尚有许多问题等待我们去深入研究,如抗原在内体与蛋白酶体间非常规转移的分子机制及其调控因素,抗原肽及自噬小体是如何与MHC分子结合的,怎么来控制抗原遵循的提呈途径,内源性抗原的交叉提呈机制等。我们应结合免疫学、分子生物学、病毒学等相关学科的先进手段和方法,以及通过各学科的交叉渗透来深入研究,解决这些问题将为恶性肿瘤和感染性疾病的防治带来新的突破。



